2016年高宁研究组发表文章揭示新的蛋白翻译调控机制
清华新闻网2016年12月7日电 近日,清华大学生命科学学院高宁课题组和合作者在《自然》(Nature)期刊在线发表题为 “ArfA、RF2介导的翻译终止机制” (Mechanistic insights into the alternative translation termination by ArfA and RF2)的研究论文,报道了细菌中在核糖体上形成的、结合有缺陷信使RNA(mRNA)的翻译终止状态复合物的高分辨冷冻电镜结构,并揭示了一类保守的小蛋白ArfA(alternative ribosome rescue factor A,另类核糖体挽救因子A)在缺陷mRNA翻译终止过程中的作用机制。

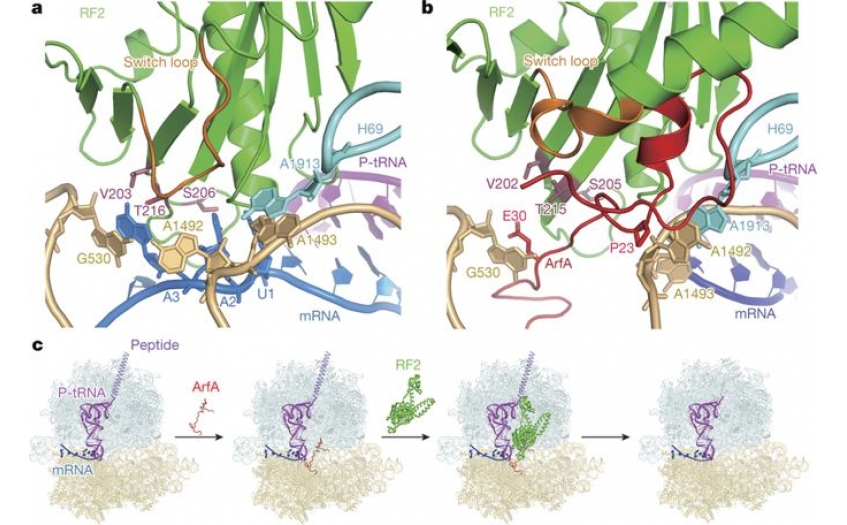
另类核糖体挽救因子A 在核糖体上的结合位点。
核糖体上的蛋白翻译是一个非常复杂的过程,包括翻译起始、延伸和终止等多步严密调控的步骤。在细菌中,当蛋白翻译进行到mRNA上的终止密码子(stop codon)时,翻译终止因子RF1或RF2可以直接识别终止密码子,结合到核糖体上的活性中心,催化释放共价偶联在肽酰tRNA 3’末端上的新生肽链。在细胞中,转录提前终止、mRNA错误加工、药物或者物理损伤等因素会导致细胞中产生缺少终止密码子的mRNA,这类有缺陷的mRNA被称为non-stop mRNA。当核糖体移动到non-stop mRNA的3’末端时,由于缺少终止密码子对RF1/RF2的激活作用,核糖体会停滞在mRNA的3’末端并且不能够进行正常的翻译终止。细胞中积累过多停滞的核糖体会产生毒性,真核生物和原核生物都进化出了相应的质量控制体系来回收这些核糖体。在细菌中,一类针对non-stop mRNA的挽救系统依赖于一种小蛋白ArfA。现有的少量遗传和生化数据表明,当核糖体停滞在non-stop mRNA的3’末端时,另类核糖体挽救因子A 结合到核糖体上的解码活性中心,招募并激活RF2的肽酰水解活性,从而释放新生肽链。然而,众多机制相关的问题尚不清楚。例如,另类核糖体挽救因子A 是如何激活RF2的水解功能?是如何区分不同长度mRNA结合的核糖体?
高宁课题组在体外组装了ArfA/RF2、non-stop mRNA、tRNA(转移tRNA)与核糖体的复合物,并获得了该复合物的高分辨冷冻电镜结构(3埃分辨率,核心区域接近2.6埃)。结构表明,另类核糖体挽救因子A其在C端的序列结合于核糖体小亚基上的mRNA入口通道,并占据了终止密码子的部分结合位点,而N端则直接与小亚基解码中心及RF2相互作用。进一步的分析表明另类核糖体挽救因子A 扮演了两个重要的角色:其N端作为mRNA长度的感受器(Sensor),如果核糖体尚未行进到mRNA的3’末端,mRNA入口通道内的核苷酸会阻碍另类核糖体挽救因子A 的结合;其C端则通过和RF2直接结合,从功能上补偿了终止密码子对RF2的激活效应。
这项研究展示了自然界的一种奇妙的功能模拟机制:具有极大结构柔性的小蛋白可以通过结构模拟来取代mRNA上的三碱基终止密码子的功能。值得一提的是,在这项工作发表的同一天,《自然》(Nature)和《科学》(Science)同时在线发表了分别来自德国慕尼黑大学威尔逊(Wilson)课题组和英国医学研究理事会分子生物学实验室(MRC-LMB)拉马克里西南(Ramakrishnan,2009诺贝化学奖获得者)课题组的相似的冷冻电镜结构工作。
高宁研究组的博士生马成英和日本弘前大学(Hirosaki University)的栗田大輔(Daisuke Kurita)博士为该论文的共同第一作者。高宁和姬野俵太(Hyouta Himeno)教授为共同通讯作者。高宁研究组成员李宁宁博士和博士生陈燕也参与了本课题的研究。电镜平台主管雷建林博士在数据收集方面给予了大量的帮助。冷冻电镜数据采集得到了国家蛋白质科学设施(北京)的清华大学冷冻电镜平台支持,数据处理得到国家蛋白质科学设施(北京)清华大学高性能计算平台的支持。部分计算处理也得到了了北京大学生命联合中心高性能计算平台的支持。本工作获得北京市结构生物学高精尖创新中心、教育部蛋白质科学重点实验室、科技部重大科学研究计划专项、国家自然科学基金委等的经费支持。
原文发布在清华大学新闻网,链接:http://news.tsinghua.edu.cn/publish/thunews/10303/2016/20161207083039233316095/20161207083039233316095_.html